研究内容について
研究課題
C型肝炎ウイルスに起因する肝硬変患者に対する自己骨髄細胞投与療法の有効性と安全性に関する研究
目 的
C型肝炎ウイルスに起因する肝硬変患者に対する自己骨髄細胞投与療法の有効性と安全性の検討を目的とする。
研究概要
ランダム化比較試験
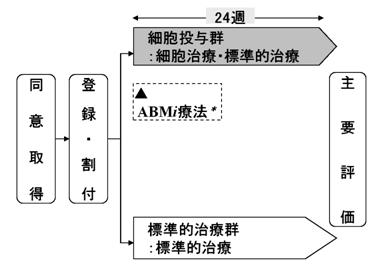
*ABMi: autologous bone marrow cell infusion therapy(自己骨髄細胞投与)
【主要評価項目】
・細胞投与群は細胞投与後,標準的治療群は登録後24週の時点でChild-Pugh Scoreの1点以上改善する割合
※先進医療A及びBについて(厚生労働省ホームページより)
○先進医療A
1 未承認等の医薬品若しくは医療機器の使用又は医薬品若しくは医療機器の適応外使用を伴わない医療技術(4に掲げるものを除く。)
2 以下のような医療技術であって、当該検査薬等の使用による人体への影響が極めて小さいもの
(1) 未承認等の体外診断薬の使用又は体外診断薬の適応外使用を伴う医療技術
(2) 未承認等の検査薬の使用又は検査薬の適応外使用を伴う医療技術
○先進医療B
3 未承認等の医薬品若しくは医療機器の使用又は医薬品若しくは医療機器の適応外使用を伴う医療技術(2に掲げるものを除く。)
4 未承認等の医薬品若しくは医療機器の使用又は医薬品若しくは医療機器の適応外使用を伴わない医療技術であって、当該医療技術の安全性、有効性等に鑑み、その実施に係り、実施環境、技術の効果等について特に重点的な観察・評価を要するものと判断されるもの。
対象者について
本院は,上記の「先進医療B」として本臨床研究を実施しており,以下の「適格基準」を満たす方を対象としています。
「適格基準」を満たさない場合は対象となりませんので十分ご注意願います。
適格基準
以下の【選択基準】をすべて満たし,かつ,以下の【除外基準】のいずれにも該当しない方を研究参加候補者とします。
【選択基準】
- ・C型肝炎ウイルスに起因する肝硬変症例
- ・90日以上離れた2点において,Child-Pugh Scoreが7点(Child-Pugh B)以上の状態にあり,現行の内科的な治療法では改善が見込めない症例
- ・20歳以上75歳以下の症例
- ・インフォームドコンセントが取得可能で,本人の研究参加への同意が得られる症例
【除外基準】
- ・C型肝炎ウイルス以外の原因で肝硬変へ至った症例,もしくは肝硬変へ至った原因が不明の症例
- ・悪性新生物を合併する,または既往を有する症例
- ・破裂の危険性を有する食道・胃静脈瘤を有する症例
- ・血清クレアチニン値2 mg/dL以上の腎機能障害を合併する症例
- ・ヘモグロビン値が8 g/dL未満,あるいは血小板数が50,000/μL未満,あるいはプロトロビン時間が40%未満の症例
- ・総ビリルビン値が3.0mg/dL以上の症例
- ・Performance Status 3あるいは4の症例
- ・同種血輸血に関する同意を得られない症例
- ・梅毒,B型肝炎ウイルス感染症,ヒト免疫不全ウイルス感染症,成人T細胞白血病ウイルス感染症,パルボウイルスB19感染症が否定できない症例
- ・妊娠中の女性
- ・全身麻酔を行うことが適切でないと担当医が総合的に判断した症例
- ・造影剤に対する重篤なアレルギーのある症例もしくは造影剤に対する重篤なアレルギーの既往を有する症例
- ・その他担当医が不適当と判断した症例
目標症例数
今回の臨床研究の目標症例は,34例です。
内訳は次のとおりです。
- ・細胞投与群 17例
- 自己骨髄細胞投与療法(ABMi 療法)を行います。
- ・標準的治療群 17例
- 自己骨髄細胞投与療法(ABMi 療法)は行わず,標準的な治療を行います。
※標準的治療群になられた方につきましても,標準的治療期間終了後,「適格基準」を満たし,かつ,担当医が可能であると判断した場合には, ご希望があり同意が得られれば,自己骨髄細胞投与療法(ABMi 療法)を行います。
症例の振り分け
本臨床研究は,ランダム化比較試験ですので,登録された方を,コンピューターにより無作為に「細胞投与群」と「標準的治療群」に振り分けます。 どちらの群になるかは1対1の確率で,ご希望に添えない場合があります。
研究参加期間
研究参加期間は24週間です。
- ・細胞投与群 :登録から細胞投与後24週時の観察が終了するまで
- ・標準的治療群:登録から標準的治療が行われ24週時の観察が終了するまで
研究方法
具体的な研究方法
- ・細胞投与群 : 約2週間入院していただき,自己骨髄細胞投与療法(ABMi 療法)を行います。 退院後,定期的に本院にお越ししいただき検査を受けていただきます。
- ・標準的治療群: 本院において標準的な治療を行い,定期的に検査を受けていただきます。
定期的検査は以下のようなスケジュールとなっております。
遠方で通院が困難な方は本研究に参加が難しい場合がございます。
| 登録 | 細胞投 与※6 | 1週 | 2週 | 4週 | 8週 | 12週 | 16週 | 20週 | 24週 /中止 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 検診・問診※1 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ |
| 血液検査※2 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ |
| 画像検査①※3 | ○ | ○ | ||||||||
| 画像検査②※4 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | |
| 肝硬変の評価※5 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ |
※1:性別,生年月,身長・体重,治療歴,合併症・既往歴,全身所見,体温,血圧,脈拍 等
※2:赤血球,白血球,血小板及び肝臓や腎臓の機能等,血液型やがん検査に関連する項目
なお一部血清を同意いただいた場合に保存します。
※3:心電図,胸部レントゲン撮影,上部消化管内視鏡
※4:腹部CT,腹部超音波,肝生検(可能な患者さんのみ実施)
※5:身体計測(アンケートを含む),肝硬変の総合的評価
※6:「細胞投与」のグループのみ。投与後1,3日時において,診察と血液検査を実施します。
参加申請について
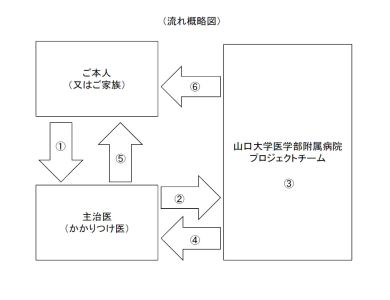
肝硬変の状態等の確認の流れ
①ご本人(又はご家族等)が,主治医(かかりつけ医)に相談
まずは,現在治療を受けておられる医療機関の主治医(かかりつけ医)にご相談いただき,上部に示した「適格基準」を満たすかどうか確認してください。
②主治医(かかりつけ医)から本院プロジェクトチームへの「診療情報提供書」及び
「適格基準スクリーニング票」の送付
現状で「適格基準」を満たす場合,主治医(かかりつけ医)より, 「診療情報提供書」及び「適格基準スクリーニング票」を本院へ郵送頂きますようお願いいたします。
郵送は,必ず「簡易書留」でお願いいたします。
③本院プロジェクトチームによる確認
送付いただきました「診療情報提供書」及び「適格基準スクリーニング票」の内容を本院プロジェクトチームで確認し, 本臨床研究の対象となるか確認いたします。
④本院から主治医(かかりつけ医)に確認結果の連絡
本院より,確認結果を文書にて主治医(かかりつけ医)に郵送いたします。
⑤主治医(かかりつけ医)より確認結果の伝達
本院での確認結果を,主治医(かかりつけ医)に確認してください。
ご本人又はご家族等から本院への,確認結果に関する直接のお問合せにはお答えすることができませんので, ご理解くださいますようお願いいたします。
⑥本院プロジェクトチームから連絡
確認結果により本臨床研究参加候補者となられた場合は,追って本院プロジェクトチームより電話で連絡させていただき, 本院での肝硬変の状態等の最終確認スケジュール(1週間程度の検査入院)を調整することとなります。最終確認の結果「適格基準」を満たしている場合に, 細胞投与群又は標準的治療群のどちらかの群に割り付けられます。 なお,本院での最終確認の検査結果によって本臨床研究に参加できない場合もございます。 十分ご理解いただきますようお願いいたします。
※適格基準スクリーニング票(様式)のPDFファイルが別ウインドウで開きます。
印刷して主治医(かかりつけ医)にお渡しください。
「診療情報提供書及び適格基準スクリーニング票」送付先
- 〒755-8505 山口県宇部市南小串1-1-1
- 山口大学医学部附属病院
- 第1内科「肝臓再生療法グループ」宛
【重要】 最終的に「適格症例」(研究参加候補者)となっても,自己骨髄細胞投与療法(ABMi 療法)が受けられるとは限りませんのでご注意願います。
臨床研究の参加終了について
研究参加者が目標症例数に到達次第,受付を終了し,その旨を本院ホームページでお知らせします。
以上を十分ご理解のいただき,本研究への参加を希望される方は,主治医(かかりつけ医)にご相談いただきますようお願いします。
主治医(かかりつけ医)に相談される際は,【印刷用PDF】を開き,印刷,ご持参の上ご相談ください。
【印刷用PDF】 (A4版で7ページあります)
(A4版で7ページあります)
※このページと同じ内容の印刷用PDFファイルが別ウインドウで開きます。
注意事項
本臨床研究に関して,電話による個別の対応はいたしかねますので,ご寛恕くださいますようお願いいたします。
何かご不明な点,ご不安な点等ございましたら,下記までメールまたはFAXにてお問い合わせください。その際は日中のご連絡先をご記載いただきますようお願いいたします。なお,お返事までに少々お時間を頂く場合がありますことをご容赦ください。
担当
- 山口大学医学部附属病院 第1内科 肝臓再生療法グループ
- 0836-22-2240
FAX 0836-22-2240
E-mail ichinai@yamaguchi-u.ac.jp

























